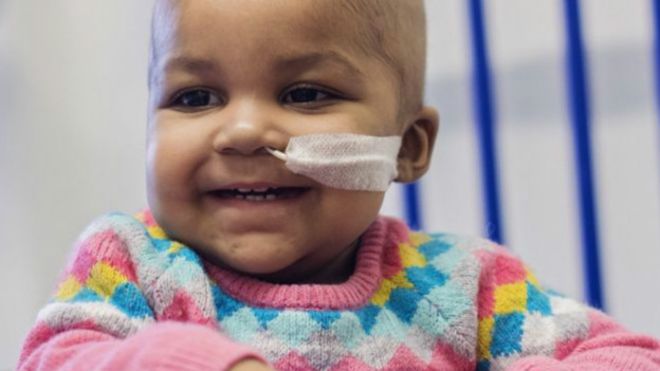
صراط: آیا چهره خندان لیلا ریچاردز نویدبخش شروع عصری تازه در پزشکی ژنتیکی است که می تواند زندگی همه ما را عوض کند؟
سرگذشت او واقعا فوق العاده است و معالجه او بدعتی در عالم پزشکی است.
یک روز مانده به جشن تولد یک سالگی لیلا، پزشکان به پدر و مادرش گفتند که همه معالجات برای درمان سرطان خون او شکست خورده و او از دست خواهد رفت.
اما با عزم خانواده، پزشکان و یک شرکت بیوتکنولوژی، او تحت معالجه ای جدید که قبلا فقط در موش آزمایش شده بود قرار گرفت.
حالا، فقط چند ماه پس از آنکه به خانواده ریچاردز گفته شد سرطان او لاعلاج است، لیلا نه تنها زنده است، بلکه کودکی شاد و خرم است که اثری از سرطان خون (لوکمیا) در او دیده نمی شود.
این معالجه "اعجازآمیز" از یک لوله آزمایشگاهی کوچک پر از سلول های ایمنی نشات گرفت که با مهندسی ژنتیک برای کشتن سرطان طراحی شده اند.
در هیجان انگیز بودن این موضوع شکی نیست و سوالاتی درباره آینده پزشکی پدید می آورد.
از حالا صحبت از انقلابی تازه در میان است: استفاده از تکنیک های مشابه برای درمان انواع سرطان ها، و همچنین سایر بیماری های وراثتی مثل کم خونی داسی شکل. البته قبلا هم در چنین موقعیتی بوده ایم.
هنگام چرخش هزاره، دانشمندان و روزنامه نگارانی فوق العاده هیجان زده مدعی بودند که ژن درمانی جهان را دگرگون خواهد کرد.
اما این اتفاق نیافتاد، بنابرین سوال این است که آیا آن "معجزه" واقعا چیزی را عوض کرده؟
پروفسور آدریان تراشر از بیمارستان گریت اورموند استریت به بی بی سی می گوید: "در آن زمان هیجان زیادی وجود داشت که غیرواقع بینانه بود، فناوری ها بسیار تازه بودند و ۱۵ تا ۲۰ سال طول کشیده تا آن فناوری های به پختگی برسند."
"من فکر می کنم که ثمره آن مطالعات اولیه الان ظاهر شده، بنابراین فکر می کنم که این واقعی است."
دی ان ای
همه انواع درمان های ژنتیکی با دستکاری دستورالعمل حیات یا همان دی ان ای همراه است، که حاوی دستور نحوه ساخت و عملکرد همه اعضای بدن است.
معروف ترین مواد پسرانی بودند که در دهه ۹۰ از به اصطلاح سندروم پسران حبابی (bubble boy) رنج می بردند.
بدن آنها فاقد سیستم ایمنی بود و مجبور بودند در شرایطی کاملا استریل زندگی کنند که به دلیل فقدان ژنی به نام IL2RG بود.
آن ژن با تزریق ویروسی حاوی کپی سالم دی ان ای در بدن بیماران جایگزین شد، اما آن آزمایش ها به دلیل ابتلای بیماران به سرطان خون رها شد.
مشکل این بود که دی ان ای تقریبا به طور تصادفی وارد بدن می شد، به شکلی که در کارکردهای طبیعی بعضی سلول ها اختلال ایجاد می کرد و آن را سرطانی می کرد.
آنچه از آن زمان تغییر کرده، دقت این عمل است.
ویروس هایی که برای انتقال دی ان ای استفاده می شود آن را در نقاطی ایمن تر در نقشه ژنتیکی قرار می دهد. به علاوه سه فناوری مهم تازه از راه رسیده است.
سه تکنیک انگشت رویی (اشاره به فلز روی)، تلن (Talens) و کریسپر (Crispr) جملگی حول یک مفهوم مشترک عمل می کنند - مثل سیستم موقعیت یاب اتومبیل عمل می کنند که راهش را به سوی نقاط مشخصی در دی ان ای پیدا می کند و حاوی یک جفت قیچی ملکولی هستند که می تواند دی ان ای را ویرایش کند.
اینها باعث ایجاد یک رشته کاملا تازه پزشکی - مهندسی ژنتیک - شده اند که نه فقط می تواند ژن های تازه را وارد کند بلکه می تواند دستور العمل حیات را بازنویسی کند.
این دقیقا اتفاقی است که در مورد لیلا افتاد.
سلول های سفید خون از یک اهداکننده گرفته شد. از تکنیک تلن برای محافظت از سلول های سالم در برابر داروهای ضدسرطانی استفاده شد.
استفاده از انگشت رویی در بیماران مبتلا به اچ آی وی وارد مرحله آزمایشی شده است. هدف این است که سلول از بدن بیمار خارج شود، طوری دستکاری شود که در برابر ویروس عامل ایدز مصون شود، و بعد دوباره وارد بدن بیمار شود.
از تکنیک کریسپر هم برای ویرايش دی ان ای جنین برای اولین بار استفاده شد که بحث انگیز بوده است.
پروفسور واسم قسیم که در درمان لیلا شرکت داشته به بی بی سی گفت: "تکنولوژی تازه پتانسیل فوق العاده ای برای درمان سایر بیماری ها دارد، از جمله برای مهندسی سلول ها و ورود دوباره آن به بدن بیمار یا دادن خواص تازه به سلول برای استفاده از آن به طوری که فقط تصور آن ممکن است."
تجهیز کردن سیستم ایمنی برای هدف گرفتن سرطان و همچنین طیف وسیعی از اختلالات موروثی در دیدرس پزشکان قرار گرفته.
برای آنها آسانترین کار این است از سلول هایی استفاده کنند که می توان آنها را از بدن خارج، اصلاح و دوباره به بدن وارد کرد، نه اینکه سلول مستقیما در داخل بدن ویرایش شود.
به این ترتیب درمان بیماری های خونی یا سیستم ایمنی - مثل تالاسمی یا کم خونی - راحت تر از درمان نقص کلیوی یا قلبی خواهد بود.
پروفسور تراشر پیش بینی می کند که در ده سال آینده شاهد "انفجار" استفاده از مهندسی ژنتیکی در درمان بیماری ها باشیم.
او می گوید: "در گذشته، برای شمار کوچکی از بیماران (بیماری ها) درمان وجود داشت اما حالا وارد روند عمومی می شود."
پس از شروع کاذب و بیش از حد خوشبینانه ۱۵ سال قبل، به نظر می رسد که ویرایش ژنتیکی درحال ورود به صحنه باشد.
سرگذشت او واقعا فوق العاده است و معالجه او بدعتی در عالم پزشکی است.
یک روز مانده به جشن تولد یک سالگی لیلا، پزشکان به پدر و مادرش گفتند که همه معالجات برای درمان سرطان خون او شکست خورده و او از دست خواهد رفت.
اما با عزم خانواده، پزشکان و یک شرکت بیوتکنولوژی، او تحت معالجه ای جدید که قبلا فقط در موش آزمایش شده بود قرار گرفت.
حالا، فقط چند ماه پس از آنکه به خانواده ریچاردز گفته شد سرطان او لاعلاج است، لیلا نه تنها زنده است، بلکه کودکی شاد و خرم است که اثری از سرطان خون (لوکمیا) در او دیده نمی شود.
این معالجه "اعجازآمیز" از یک لوله آزمایشگاهی کوچک پر از سلول های ایمنی نشات گرفت که با مهندسی ژنتیک برای کشتن سرطان طراحی شده اند.
در هیجان انگیز بودن این موضوع شکی نیست و سوالاتی درباره آینده پزشکی پدید می آورد.
از حالا صحبت از انقلابی تازه در میان است: استفاده از تکنیک های مشابه برای درمان انواع سرطان ها، و همچنین سایر بیماری های وراثتی مثل کم خونی داسی شکل. البته قبلا هم در چنین موقعیتی بوده ایم.
هنگام چرخش هزاره، دانشمندان و روزنامه نگارانی فوق العاده هیجان زده مدعی بودند که ژن درمانی جهان را دگرگون خواهد کرد.
اما این اتفاق نیافتاد، بنابرین سوال این است که آیا آن "معجزه" واقعا چیزی را عوض کرده؟
پروفسور آدریان تراشر از بیمارستان گریت اورموند استریت به بی بی سی می گوید: "در آن زمان هیجان زیادی وجود داشت که غیرواقع بینانه بود، فناوری ها بسیار تازه بودند و ۱۵ تا ۲۰ سال طول کشیده تا آن فناوری های به پختگی برسند."
"من فکر می کنم که ثمره آن مطالعات اولیه الان ظاهر شده، بنابراین فکر می کنم که این واقعی است."
دی ان ای
همه انواع درمان های ژنتیکی با دستکاری دستورالعمل حیات یا همان دی ان ای همراه است، که حاوی دستور نحوه ساخت و عملکرد همه اعضای بدن است.
دستور العمل ساخت و حفظ اندام ها در دی ان ای نهفته است
در نمونه های اولیه این درمان ها، دی ان ای تازه وارد سلول بیمارانی می شد که دستورالعمل ژنتیکی آنها ناقص یا معیوب بود.معروف ترین مواد پسرانی بودند که در دهه ۹۰ از به اصطلاح سندروم پسران حبابی (bubble boy) رنج می بردند.
بدن آنها فاقد سیستم ایمنی بود و مجبور بودند در شرایطی کاملا استریل زندگی کنند که به دلیل فقدان ژنی به نام IL2RG بود.
آن ژن با تزریق ویروسی حاوی کپی سالم دی ان ای در بدن بیماران جایگزین شد، اما آن آزمایش ها به دلیل ابتلای بیماران به سرطان خون رها شد.
مشکل این بود که دی ان ای تقریبا به طور تصادفی وارد بدن می شد، به شکلی که در کارکردهای طبیعی بعضی سلول ها اختلال ایجاد می کرد و آن را سرطانی می کرد.
آنچه از آن زمان تغییر کرده، دقت این عمل است.
ویروس هایی که برای انتقال دی ان ای استفاده می شود آن را در نقاطی ایمن تر در نقشه ژنتیکی قرار می دهد. به علاوه سه فناوری مهم تازه از راه رسیده است.
سه تکنیک انگشت رویی (اشاره به فلز روی)، تلن (Talens) و کریسپر (Crispr) جملگی حول یک مفهوم مشترک عمل می کنند - مثل سیستم موقعیت یاب اتومبیل عمل می کنند که راهش را به سوی نقاط مشخصی در دی ان ای پیدا می کند و حاوی یک جفت قیچی ملکولی هستند که می تواند دی ان ای را ویرایش کند.
اینها باعث ایجاد یک رشته کاملا تازه پزشکی - مهندسی ژنتیک - شده اند که نه فقط می تواند ژن های تازه را وارد کند بلکه می تواند دستور العمل حیات را بازنویسی کند.
این دقیقا اتفاقی است که در مورد لیلا افتاد.
سلول های سفید خون از یک اهداکننده گرفته شد. از تکنیک تلن برای محافظت از سلول های سالم در برابر داروهای ضدسرطانی استفاده شد.
آنچه از ۱۵ سال پیش تا حالا تغییر کرده، دقت در وارد کردن دی ان ای اصلاح شده به بدن است
با کمک یک ویروس، ژنی تازه وارد بدن بیمار شد که باعث حمله به سلول سرطان خون می شود.استفاده از انگشت رویی در بیماران مبتلا به اچ آی وی وارد مرحله آزمایشی شده است. هدف این است که سلول از بدن بیمار خارج شود، طوری دستکاری شود که در برابر ویروس عامل ایدز مصون شود، و بعد دوباره وارد بدن بیمار شود.
از تکنیک کریسپر هم برای ویرايش دی ان ای جنین برای اولین بار استفاده شد که بحث انگیز بوده است.
پروفسور واسم قسیم که در درمان لیلا شرکت داشته به بی بی سی گفت: "تکنولوژی تازه پتانسیل فوق العاده ای برای درمان سایر بیماری ها دارد، از جمله برای مهندسی سلول ها و ورود دوباره آن به بدن بیمار یا دادن خواص تازه به سلول برای استفاده از آن به طوری که فقط تصور آن ممکن است."
تجهیز کردن سیستم ایمنی برای هدف گرفتن سرطان و همچنین طیف وسیعی از اختلالات موروثی در دیدرس پزشکان قرار گرفته.
برای آنها آسانترین کار این است از سلول هایی استفاده کنند که می توان آنها را از بدن خارج، اصلاح و دوباره به بدن وارد کرد، نه اینکه سلول مستقیما در داخل بدن ویرایش شود.
به این ترتیب درمان بیماری های خونی یا سیستم ایمنی - مثل تالاسمی یا کم خونی - راحت تر از درمان نقص کلیوی یا قلبی خواهد بود.
پروفسور تراشر پیش بینی می کند که در ده سال آینده شاهد "انفجار" استفاده از مهندسی ژنتیکی در درمان بیماری ها باشیم.
او می گوید: "در گذشته، برای شمار کوچکی از بیماران (بیماری ها) درمان وجود داشت اما حالا وارد روند عمومی می شود."
پس از شروع کاذب و بیش از حد خوشبینانه ۱۵ سال قبل، به نظر می رسد که ویرایش ژنتیکی درحال ورود به صحنه باشد.