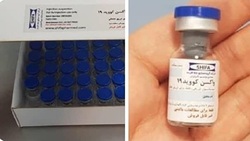
واکسن کرونای ایرانی از زمان شیوع بیماری در کشور توسط محققان ایرانی مراحل تولید خود را پیش گرفت و بعد از حدود ۱۰ ماه از شیوع این بیماری در کشور، واکسن تولید شده در شرکت شفا فارمد وابسته به ستاد اجرایی فرمان امام به مرحله تست بالینی انسانی نزدیک شده است.
به گزارش باشگاه خبرنگاران جوان، کارآزمایی بالینی بررسی بی خطری و ایمونوژنیسیتی واکسن غیر فعال COVID-۱۹ (شرکت شفافارمد) در جمعیت سالم با هدف تعیین بی خطری و ایمونوژنیسیتی واکسن غیر فعال COVID-۱۹ در جمعیت سالم مورد مطالعه قرار گرفته است.
این مطالعه دوسوکور (داوطلبین و ارزیابی کنندگان پیامد) دارای پلاسبو بر روی ۵۶ فرد داوطلب سالم در هر دو جنسیت در محل هتل ارم تهران (تجهیز شده برای کارآزمایی بالینی) انجام خواهد شد. داوطلبان پس از دریافت تصادفی دوز ۳ یا ۵ میکروگرم واکسن یا پلاسبو (بر اساس دو مرحله مطالعه دوز کم و دوز زیاد) دو نوبت در روزهای صفر و ۱۴ واکسن را دریافت و تا روز ۲۸ از جهت بررسی عوارض، ایمنی هومورال و سلولار پیگیری اولیه میشوند. تمامی افراد پس پایان مطالعه تا روز ۳۶۰ نیز پیگیری طولانی مدت خواهد شد.
طبق ارزیابیهای انجام شده تاریخ شروع بیمار گیری مورد انتظار ۲۰۲۰/۱۲/۲۱، ۱۳۹۹/۱۰/۰۱و تاریخ پایان بیمارگیری مورد انتظار ۲۰۲۱/۰۲/۱۸، ۱۳۹۹/۱۱/۳۰ خواهد بود.
ویژگیهایی که داوطلبان دریافت واکسن ایرانی COVID-۱۹ نباید داشته باشند:
۱) مورد تأیید شده، مشکوک یا بدون علامت COVID-۱۹ که با انجام PCR در بدو ورود به مطالعه مشخص میشود.
۲) آنتی بادی مثبت COVID-۱۹ سابقه ابتلا به عفونت SARS-CoV-۲،
۳) سابقه تماس با فرد مبتلا به عفونت SARS-CoV-۲ (با تست PCR مثبت) در طی ۱۴ روز اخیر
۴) افرادی که در بازه زمانی گذراندن دوران قرنطینه خانگی به علت کووید (شک به مواجهه یا علایم مشکوک) هستند تب (دمای آگزیلاری بیش از ۳۷ درجه) سرفه خشک، خستگی مفرط، انسداد بینی، آبریزش بینی، گلودرد، درد عضلانی، اسهال، تنگی نفس و shortness of breath
۵) در طی ۱۴ روز قبل از تلقیح واکسن موارد غیر نرمال در آزمایشات بیوشیمی، خون و ادرار قبل از تلقیح واکسن تجربه
۶) واکنشهای شدید آلرژیک یا آلرژی به اجزای واکسن غیرفعال COVID-۱۹،
۷) سابقه شخصی یا خانوادگی تشنج، صرع، آنسفالوپاتی یا اختلالات روانپزشکی وجود مالفورماسیونهای مادرزادی سابقه بیماریهای نورولوژیک یا seizure شامل گیلن باره (به استثنای تب و تشنج دوران کودکی)
۸) اختلالات رشدی هر گونه نقص ژنتیکی
۹) شرح حال یا علائم سو تغذیه بیماری
۱۰) هپاتورنال فشار خون کنترل نشده
۱۱) داشتن عوارض دیابت BMI بیش از ۴۰،
۱۲) وجود هر گونه بدخیمی ابتلا به بیماری حاد یا exacerbation
۱۳) بیماری مزمن در ۷ روز اخیر مورد شناخته شده نقص سیستم ایمنی، HIV، لنفوم، لوکمی یا سایر بیماریهای اتوایمون بیماری تیرویید یا سابقه تیروییدکتومی طحال برداری یا سابقه برداشتن سایر ارگانهای مهم به هر دلیل
۱۴) سابقه اختلالات انعقادی دریافت درمان ضد سل مثبت بودن HBSAg
۱۵) مثبت بودن HIV
۱۶) مثبت بودن HCV antibody دریافت
۱۷) درمان تقویت کننده یا مهارکننده سیستم ایمنی به مدت حداقل ۱۴ روز متوالی در طی سه ماه اخیر
۱۸) دریافت واکسن زنده طی یک ماه قبل از تلقیح یا دریافت سایر واکسنها در طی ۱۴ روز اخیر
۱۹) سابقه سوء مصرف الکل یا مواد مخدر
۲۰) دریافت ایمونوگلوبولین یا فراوردههای خونی طی سه ماه قبل از تلقیح واکسن
۲۱) دریافت سایر داروهای پژوهشی طی ۶ ماه قبل از تلقیح واکسن
۲۲) داشتن برنامه برای دریافت هر واکسن دیگری در یک ماه بعد از تلقیح واکسن مطالعه
۲۳) داشتن اختلالات شدید روانپزشکی اثرگذار بر شرکت
۲۴) در مطالعه زنان باردار یا شیرده یا کسانی که قصد و تمایل بارداری در طول زمان مطالعه را دارند
۲۵) داشتن شغل پرخطر مواجهه با ویروس SARS-CoV-۲ یا داشتن خطر بالای مواجهه طبق نظر محقق
۲۶) هر شرایط دیگری خارج از موارد فوق که به نظر محقق، فرد را برای شرکت در کارآزمایی بالینی نامناسب میکند.
گفتنی است؛ هر دوز واکسن به صورت جداگانه بسته بندی شده و دارای شماره شناسایی است. ویال و جعبههای واکسن و پلاسبو در ظاهر و بسته بندیهای کاملا مشابه عرضه میشوند که باعث کورسازی شرکت کنندگان، محقق و ارزیابی کنندگان پیامد خواهد بود.
کمیته پایش داده و ایمنی (DSMB) در سراسر مطالعه ناظر ایمنی مطالعه است. این کمیته از هفت عضو مستقل (شامل تخصصهای عفونی، ایمنی شناسی، ویروس شناسی، اپیدمیولوژی، واکسن شناس و ...) تشکیل شده است. کمیته DSMB در بازههای زمانی ۷ روز پس از تکمیل اطلاعات ۳ داوطلب اول، ۷ داوطلب، ۱۴ داوطلب، ۲۱ داوطلب و سپس در ادامه ۱۴ روز پس از ورود ۳۵ مین داوطلب و ۲۸ روز پس از ورود ۵۶ داوطلب تشکیل میشود. گزارش ایمنی داوطلبان تک به تک مرور و نتیجه این کمیته به سازمانهای رگولاتور اعلام میشود. پیشرفت مطالعه از هر مرحله به هر مرحله بالاتر صرفا با تایید DSMB و نهاد رگولاتور (سازمان غذا دارو و کمیته ملی اخلاق) اتفاق میافتد.
بر اساس مرکز ثبت کارآزمایی بالینی ایران سازمان رگولاتوری و کمیته اخلاق اجازه دسترسی به دادههای مطالعه را خواهند داشت. تیم مونیتورینگ مطالعه در حین مطالعه به دادههای مطالعه دسترسی دارد، کمیته DSMB به دادهها و نتایج مطالعه در مقاطع مشخص شده دسترسی خواهد داشت و برای ادامه مطالعه تصمیم گیری خواهند کرد.
به گزارش باشگاه خبرنگاران جوان، کارآزمایی بالینی بررسی بی خطری و ایمونوژنیسیتی واکسن غیر فعال COVID-۱۹ (شرکت شفافارمد) در جمعیت سالم با هدف تعیین بی خطری و ایمونوژنیسیتی واکسن غیر فعال COVID-۱۹ در جمعیت سالم مورد مطالعه قرار گرفته است.
این مطالعه دوسوکور (داوطلبین و ارزیابی کنندگان پیامد) دارای پلاسبو بر روی ۵۶ فرد داوطلب سالم در هر دو جنسیت در محل هتل ارم تهران (تجهیز شده برای کارآزمایی بالینی) انجام خواهد شد. داوطلبان پس از دریافت تصادفی دوز ۳ یا ۵ میکروگرم واکسن یا پلاسبو (بر اساس دو مرحله مطالعه دوز کم و دوز زیاد) دو نوبت در روزهای صفر و ۱۴ واکسن را دریافت و تا روز ۲۸ از جهت بررسی عوارض، ایمنی هومورال و سلولار پیگیری اولیه میشوند. تمامی افراد پس پایان مطالعه تا روز ۳۶۰ نیز پیگیری طولانی مدت خواهد شد.
طبق ارزیابیهای انجام شده تاریخ شروع بیمار گیری مورد انتظار ۲۰۲۰/۱۲/۲۱، ۱۳۹۹/۱۰/۰۱و تاریخ پایان بیمارگیری مورد انتظار ۲۰۲۱/۰۲/۱۸، ۱۳۹۹/۱۱/۳۰ خواهد بود.
ویژگیهایی که داوطلبان دریافت واکسن ایرانی COVID-۱۹ نباید داشته باشند:
۱) مورد تأیید شده، مشکوک یا بدون علامت COVID-۱۹ که با انجام PCR در بدو ورود به مطالعه مشخص میشود.
۲) آنتی بادی مثبت COVID-۱۹ سابقه ابتلا به عفونت SARS-CoV-۲،
۳) سابقه تماس با فرد مبتلا به عفونت SARS-CoV-۲ (با تست PCR مثبت) در طی ۱۴ روز اخیر
۴) افرادی که در بازه زمانی گذراندن دوران قرنطینه خانگی به علت کووید (شک به مواجهه یا علایم مشکوک) هستند تب (دمای آگزیلاری بیش از ۳۷ درجه) سرفه خشک، خستگی مفرط، انسداد بینی، آبریزش بینی، گلودرد، درد عضلانی، اسهال، تنگی نفس و shortness of breath
۵) در طی ۱۴ روز قبل از تلقیح واکسن موارد غیر نرمال در آزمایشات بیوشیمی، خون و ادرار قبل از تلقیح واکسن تجربه
۶) واکنشهای شدید آلرژیک یا آلرژی به اجزای واکسن غیرفعال COVID-۱۹،
۷) سابقه شخصی یا خانوادگی تشنج، صرع، آنسفالوپاتی یا اختلالات روانپزشکی وجود مالفورماسیونهای مادرزادی سابقه بیماریهای نورولوژیک یا seizure شامل گیلن باره (به استثنای تب و تشنج دوران کودکی)
۸) اختلالات رشدی هر گونه نقص ژنتیکی
۹) شرح حال یا علائم سو تغذیه بیماری
۱۰) هپاتورنال فشار خون کنترل نشده
۱۱) داشتن عوارض دیابت BMI بیش از ۴۰،
۱۲) وجود هر گونه بدخیمی ابتلا به بیماری حاد یا exacerbation
۱۳) بیماری مزمن در ۷ روز اخیر مورد شناخته شده نقص سیستم ایمنی، HIV، لنفوم، لوکمی یا سایر بیماریهای اتوایمون بیماری تیرویید یا سابقه تیروییدکتومی طحال برداری یا سابقه برداشتن سایر ارگانهای مهم به هر دلیل
۱۴) سابقه اختلالات انعقادی دریافت درمان ضد سل مثبت بودن HBSAg
۱۵) مثبت بودن HIV
۱۶) مثبت بودن HCV antibody دریافت
۱۷) درمان تقویت کننده یا مهارکننده سیستم ایمنی به مدت حداقل ۱۴ روز متوالی در طی سه ماه اخیر
۱۸) دریافت واکسن زنده طی یک ماه قبل از تلقیح یا دریافت سایر واکسنها در طی ۱۴ روز اخیر
۱۹) سابقه سوء مصرف الکل یا مواد مخدر
۲۰) دریافت ایمونوگلوبولین یا فراوردههای خونی طی سه ماه قبل از تلقیح واکسن
۲۱) دریافت سایر داروهای پژوهشی طی ۶ ماه قبل از تلقیح واکسن
۲۲) داشتن برنامه برای دریافت هر واکسن دیگری در یک ماه بعد از تلقیح واکسن مطالعه
۲۳) داشتن اختلالات شدید روانپزشکی اثرگذار بر شرکت
۲۴) در مطالعه زنان باردار یا شیرده یا کسانی که قصد و تمایل بارداری در طول زمان مطالعه را دارند
۲۵) داشتن شغل پرخطر مواجهه با ویروس SARS-CoV-۲ یا داشتن خطر بالای مواجهه طبق نظر محقق
۲۶) هر شرایط دیگری خارج از موارد فوق که به نظر محقق، فرد را برای شرکت در کارآزمایی بالینی نامناسب میکند.
گفتنی است؛ هر دوز واکسن به صورت جداگانه بسته بندی شده و دارای شماره شناسایی است. ویال و جعبههای واکسن و پلاسبو در ظاهر و بسته بندیهای کاملا مشابه عرضه میشوند که باعث کورسازی شرکت کنندگان، محقق و ارزیابی کنندگان پیامد خواهد بود.
کمیته پایش داده و ایمنی (DSMB) در سراسر مطالعه ناظر ایمنی مطالعه است. این کمیته از هفت عضو مستقل (شامل تخصصهای عفونی، ایمنی شناسی، ویروس شناسی، اپیدمیولوژی، واکسن شناس و ...) تشکیل شده است. کمیته DSMB در بازههای زمانی ۷ روز پس از تکمیل اطلاعات ۳ داوطلب اول، ۷ داوطلب، ۱۴ داوطلب، ۲۱ داوطلب و سپس در ادامه ۱۴ روز پس از ورود ۳۵ مین داوطلب و ۲۸ روز پس از ورود ۵۶ داوطلب تشکیل میشود. گزارش ایمنی داوطلبان تک به تک مرور و نتیجه این کمیته به سازمانهای رگولاتور اعلام میشود. پیشرفت مطالعه از هر مرحله به هر مرحله بالاتر صرفا با تایید DSMB و نهاد رگولاتور (سازمان غذا دارو و کمیته ملی اخلاق) اتفاق میافتد.
بر اساس مرکز ثبت کارآزمایی بالینی ایران سازمان رگولاتوری و کمیته اخلاق اجازه دسترسی به دادههای مطالعه را خواهند داشت. تیم مونیتورینگ مطالعه در حین مطالعه به دادههای مطالعه دسترسی دارد، کمیته DSMB به دادهها و نتایج مطالعه در مقاطع مشخص شده دسترسی خواهد داشت و برای ادامه مطالعه تصمیم گیری خواهند کرد.